- PDNレクチャーとは?
- Chapter1 PEG
- Chapter2 経腸栄養
- 1.経腸栄養の特徴と適応
- 2.経腸栄養剤の分類
- 3.病態別経腸栄養剤
- 3.1 病態別経腸栄養剤とは?
- 3.2 肝不全用栄養剤
- 3.3 腎不全用栄養剤
- 3.4 糖尿病用栄養剤
- 3.5 呼吸不全用栄養剤
- 3.6 免疫賦活栄養剤、免疫調節栄養剤
- 4.経腸栄養に用いられる製剤および食品
- 4.1 グルタミン製剤(食品)
- 4.2 微量元素製剤
- 4.3 食物繊維
- 4.4 プロバイオティクス、シンバイオティクス
- ① プロバイオティクス
- ② シンバイオティクス
- 4.5 ORS(経口補水液)
- 4.6 増粘剤、ゲル化剤
- 4.7 脂肪酸
- ① 脂肪酸とその分類
- ② 多価不飽和脂肪酸(ω-3, ω-6系)
- ③ 中鎖脂肪酸(MCT)
- 5.半固形化栄養剤
- 5.1 基礎的な知識
- 5.2 臨床的な知識
- ①胃瘻からの半固形化栄養材
短時間注入法 - ②栄養剤形状機能について
- 6.ミキサー食
- 6.1 ミキサー食(成人)
- 6.2 ミキサー食(小児)
- 6.3 ミキサー食(小児)
- 7.早期経腸栄養
- 8.周術期経腸栄養
- 9.在宅経腸栄養
- 9.1 在宅経腸栄養
- 9.2 在宅診療の医療費の実際
- 9.3 終末期医療にかかる費用
- 10.経腸栄養に必要な器具
- 11.経腸栄養時の薬剤投与
- 12.経腸栄養の管理
- 13.経腸栄養の合併症と対策
- 14.栄養剤使用時の栄養アセスメント
- ●「経腸栄養」関連製品一覧
- Chapter3 静脈栄養
- Chapter4 摂食・嚥下リハビリ
- PDNレクチャーご利用にあたって



Chapter2 経腸栄養
4.経腸栄養に用いられる製剤および食品
4.プロバイオティクス、
シンバイオティクス
②シンバイオティクス
株式会社ヤクルト本社 中央研究所 朝原 崇

2025年10月20日改訂
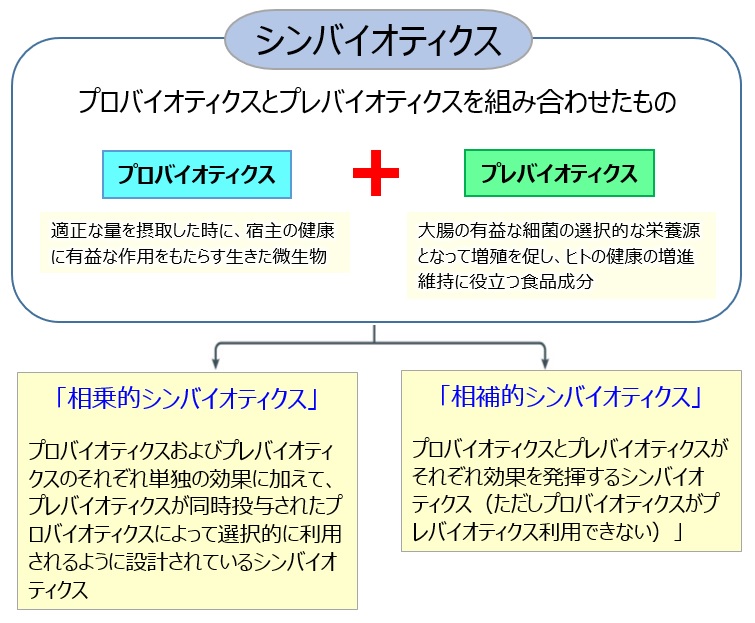
1.シンバイオティクスとは
シンバイオティクス(synbiotics)とは、「適正な量を摂取した時に、宿主の健康に有益な作用をもたらす生きた微生物」であるプロバイオティクス1,2)(probiotics)と、「消化管上部で分解・吸収されず、大腸の有益な細菌の選択的な栄養源となって増殖を促し、ヒトの健康の増進維持に役立つ食品成分」であるプレバイオティクス3)(prebiotics)を組み合わせたものであり、その概念は1995年にGibson らにより提唱された3)(図1)。さらに、2019年のシンバイオティクスの定義と範囲に関するプロバイオティクスおよびプレバイオティクス国際科学会議(ISAPP:International Scientific Association for Probiotics and Prebiotics)の合意声明4)において、シンバイオティクスは「相乗的シンバイオティクス」と「相補的シンバイオティクス」の2つに分類された(図1)。シンバイオティクスは、プロバイオティクス、あるいはプレバイオティクスの単独使用に比べより強い効果が期待できることから、近年、医学領域において臨床研究でのエビデンスの蓄積とともにシンバイオティクスが注目されてきている。
2.シンバイオティクスの有用性についての学術的見解
医学においては、EBM(evidence-based medicine)という実験的証拠に基づいた治療法の評価が重要視されていることから、医療に用いられるシンバイオティクスについては、無作為化比較試験(RCT)が実施されている。また、複数のRCTの結果を統合し、より高い見地からエビデンスを分析するメタアナリシスが複数試みられている。
ヨーロッパ臨床栄養代謝学会(European Society for Clinical Nutrition and Metabolism)の学会誌に、周術期の患者におけるシンバイオティクスの有用性に関するメタアナリシス5)の論文が報告されている。周術期のシンバイオティクスの利用は、感染性合併症が減少し、QOLが改善され、副作用が少なく、病院のコストが低減されることから、外科患者の補助療法として推奨されている。また、米国外科学会の学会誌に掲載された腹部手術患者を対象としたメタアナリシスの論文6)では、シンバイオティクスの有効性のみならず使用する場合の考え方についても言及しており、結論として、①世の中に存在する全てのプロバイオティクス・シンバイオティクスが同等な効果を発揮すると解釈することはできない、②したがって、本メタアナリシスの結果は、個々のRCTで有益な効果が明らかにされた菌株にのみ適用できることを強調しておく、と述べられている。以上のことから、医療に利用されるシンバイオティクスは、厳密なRCTで有効性が明らかになっている症例とそのシンバイオティクスの組み合わせで用いるべきであり、そのような観点に基づいた臨床的なエビデンスの蓄積が必須であると考えられている。
3.医療におけるシンバイオティクスのエビデンス
生体への高度な侵襲は腸管や腸内細菌叢にダメージを与えるため、特に侵襲の大きな消化器外科手術後の患者やICU入室の重症患者では、シンバイオティクスの有用性に関するRCTのエビデンスが取得されている。
前述の腹部消化器手術のメタアナリシス6)で採用されていたシンバイオティクスのRCT論文 18報の詳細を表1に示した。肝切除や肝移植、食道癌手術などの侵襲の大きな消化器手術が対象となっており、主要評価項目は本領域で大きな問題となっている感染性合併症であった。メタアナリシスの結果として、シンバイオティクスが感染性合併症のリスク低減、在院日数の短縮、生存率の上昇に有用であることが示されている(表2)。エビデンスが示されているシンバイオティクスの種類に注目してみると、日本7-12)とスウェーデン13-16) の2つのシンバイオティクスに集中していることが分かる。
Batraら17)のメタアナリシスで採用された重症ICU患者を対象としたプロバイオティクス、シンバイオティクスの人工呼吸器関連肺炎(VAP)予防に関するRCT臨床研究(論文9報)の詳細を表2に示した。プロバイオティクスおよびシンバイオティクスがVAPの頻度、人工呼吸器の使用期間、在院日数、下痢の頻度17,18)を有意に減少させることが報告されている。興味深いことにVAP患者を対象としたRCTにて有用性が明らかにされているスウェーデン19-21)と日本22)の2つのシンバイオティクスは、いずれも前述の腹部手術のRCTで感染性合併症に有用であることが示されているシンバイオティクスと同一であった。世界中に多種多様なプロバイオティクスおよびプレバイオティクスが存在する中で、エビデンスレベルの高いRCTにて有効性が証明されているのは特定のシンバイオティクスに限られている。そのような複数のエビデンスがあるシンバイオティクスについては、明確な効果のメカニズムがあると推察される。
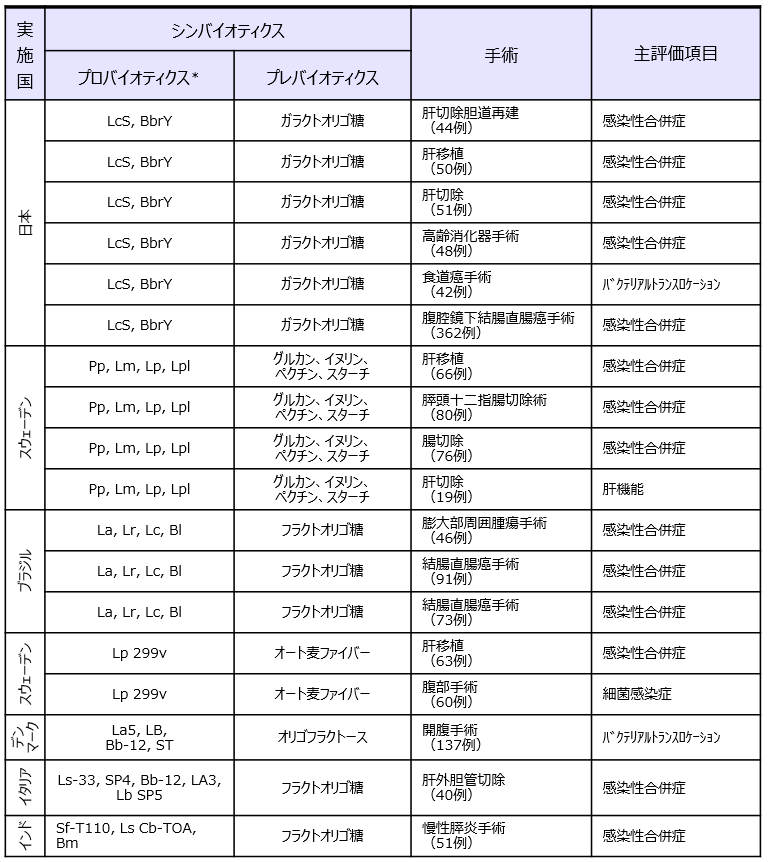
*LcS:Lacticaseibacillus paracasei (the previous taxonomic nomenclature was Lactobacillus casei)strain Shirota、BbrY:Bifidobacterium breve strain Yakult、Pp:Pediococcus pentosaceus 5-33:3、Lm:Leuconostoc mesenteroides 77:1、Lp:Lactobacillus paracasei ssp. paracasei F19、Lpl:Lactobacillus plantarum 2362、La:Lactobacillus acidophilus NCFM、Lr:Lactobacillus rhamnosus HN001、Lc:Lactobacillus paracasei LPC-37、Bl:Bifidobacterium lactis HN019、Lp 299v:Lactobacillus plantarum 299v、La5:Lactobacillus acidophilus La5、Bb12:Bifidobacterium lactis Bb-12、ST:Streptococcus thermophilus、LB:Lactobacillus bulgaricus、Bb-Bl02:Bifidobacterium bifidum/Bifidobacterium lactis Bb-02、SP4:Streptococcus thermophilus SP4、LA3:Lactobacillus acidophilus LA3、LbSP5:Lactobacillus bulgaricus SP5、BGP93:Lactobacillus casei BGP93、SfT110:Streptococcus faecalis T-110、CbuT:Clostridium butyricum TOA、BmT:Bacillus mesentericus TO-A、Lsp:Lactobacillus sporogenes
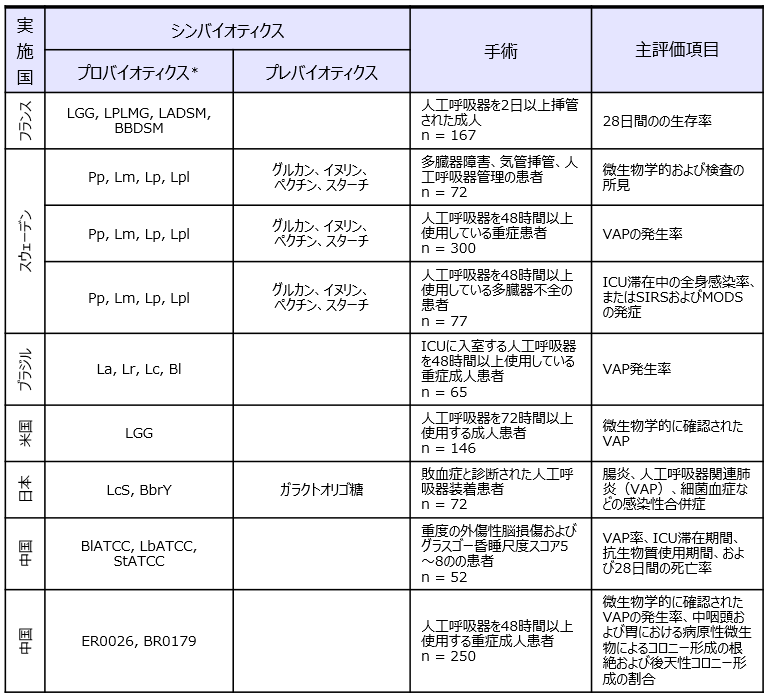
*LGG:Lactobacillus rhamnosus GG、 LPLMG:Lactobacillus paracasei LMG P-21380、LADSM:Lactobacillus acidophilus DSM21717、 BBDSM:Bifidobacterium bifidum DSM22892、La:Lactobacillus acidophilus NCFM、Lr:Lactobacillus rhamnosus HN001、Lc:Lactobacillus paracasei LPC-37:Bl:Bifidobacterium lactis HN019、Pp:Pediococcus pentosaceus 5-33:3、Lm:Leuconostoc mesenteroides 77:1、Lp:Lactobacillus paracasei ssp. paracasei F19、Lpl:Lactobacillus plantarum 2362、LcS:Lacticaseibacillus paracasei (the previous taxonomic nomenclature was Lactobacillus casei)strain Shirota、BbrY:Bifidobacterium breve strain Yakult、BlATCC:Bifidobacterium longum subsp. infantis ATCC15697、LbATCC:Lactobacillus bulgaricus ATCC11842、StATCC:Streptococcus thermophilus ATCC19987、ER0026:Enterococcus faecium R0026、BR0179:Bacillus subtilis R0179
4.シンバイオティクスの有効性のメカニズム
プロバイオティクスとシンバイオティクスの有効性のメカニズムについては、In vitroやIn vivoでの基礎研究のエビデンスが前提に議論されており、臨床研究にて作用機作を示しているエビデンスは少ない。しかしながらそのような中で、一部のプロバイオティクスおよびシンバイオティクスについては臨床研究にてメカニズムの検討が行われており、それらの結果をまとめた作用機作に関するメタアナリシスも報告されている23)。手術部位感染症(SSI)を呈する手術患者において、乱れた腸内細菌叢の改善(宿主に有益な腸内細菌の増加および感染リスクのある菌の減少)に加えて、腸の免疫応答と短鎖脂肪酸の産生を調節することにより効果が発揮されていることが示されている。
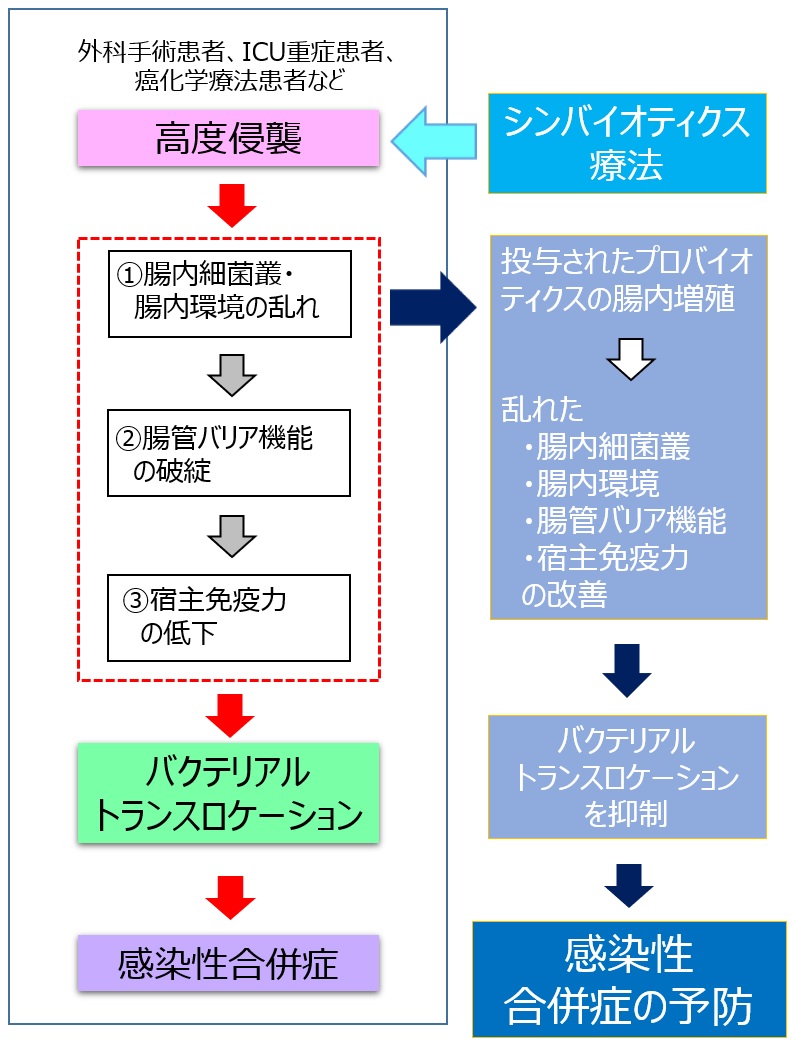
特定のシンバイオティクスについては、さらに踏み込んだメカニズムの検討が進んでいる。周術期の患者や癌化学療法を受けるような患者では、侵襲による腸内細菌叢の乱れ、腸管上皮のバリア機能の破綻、宿主免疫力の低下により、バクテリアルトランスロケーション(腸管内の細菌が腸管粘膜を介して生体内に移行し感染を引き起こすこと)が生じ、これが有害事象や感染性合併症の原因の一つであると考えられている(図2)。シンバイオティクスが投与された癌患者では、投与されたプロバイオティクスの腸内増殖による腸内細菌叢や腸内環境の改善に伴い、手術や癌化学療法により生じるバクテリアルトランスロケーションが強く抑制されることが明らかにされている(図2)11, 24)。
以上のメカニズムを考えると、シンバイオティクスは生体に高度な侵襲が加えられる前から予防的に投与する必要があると考えられる。実際に、手術後にシンバイオティクスの投与を開始するよりも、手術前から開始した方が、胆道癌患者における術後感染性合併症が強く抑制されることが示されている25)。
5.今後の展望
近年、シンバイオティクスは、適応症例の拡大が検討されている。術前癌化学療法中の食道癌患者の有害事象対策としては、抗菌薬の投与が一般的であるが、抗菌薬の汎用は耐性菌の出現や伝播を促すことから、使用量の低減は重要な課題である。そこで術前癌化学療法中の食道癌患者を対象に、抗菌薬を投与した群と抗菌薬をシンバイオティクスに置き換えた対照群にて、発熱性好中球減少症や重篤な下痢への影響を比較したところ、シンバイオティクス群ではそれらの有害事象が軽減されることが明らかになった26)。さらに本シンバイオティクスの有害事象軽減作用は、整腸剤と比較した場合にも有意に強いことが示されている27)。癌患者における新たなシンバイオティクスの使用法が示されたことに加えて、世界的に増加している多剤耐性菌の感染拡大への新しい対抗策としても注目されている。
さらに、高度な侵襲に晒されていない比較的身近な疾患の中でも、腸管のバリア機能が破綻して透過性が亢進しているような疾患では、シンバイオティクスの有用性が期待されている。肥満、二型糖尿病、非アルコール性脂肪肝疾患、慢性腎臓病といった生活習慣病や、炎症性腸疾患、関節リウマチといった自己免疫疾患において、シンバイオティクスの投与が症状の緩和に役立つ可能性を示したRCTが増えてきている。
これまで蓄積されてきたエビデンスや臨床でのシンバイオティクスの利用実績から、最新の“診療ガイドライン”にて、シンバイオティクスの投与の必要性が検討されるまでになった。「日本版重症患者の栄養療法ガイドライン2024」28)や「胆道癌診療ガイドライン改訂第4版」29)のクリニカルクエスチョンでは、重症患者や周術期患者に対するシンバイオティクスの投与が推奨されている。ただし、エビデンスの確実性については、単施設の試験が多いこともあり、「低い」との判断であった。そのため、現在、特定の症例において、大規模なシンバイオティクスの多施設共同試験が進行中である。診療ガイドライン”へのシンバイオティクスの収載による標準治療への発展が期待される。
様々な病態にシンバイオティクスが利用される機会が増えれば、シンバイオティクスの安全性についても慎重な考えが必要である4)。臨床で使用されるシンバイオティクスについては、有効性のエビデンスは当然ながら、有害事象の報告にも注意する必要があると考えられる。
文献
- Fuller R: J Appl Bacteriol 66: 365-378, 1989
- Joint FAO/WHO Working Group Report on Drafting Guidelines for the Evaluation of Probiotics in Food, 2002
- Gibson GR, Roberfroid MB: J Nutr 125: 1401-1412, 1995
- Swanson KS et al: Nat Rev Gastroenterol Hepatol 17: 687-701, 2020
- WU XD et al: Clin Nutr 37: 505-515, 2018
- Chowdhury AH et al: Ann Surg 271: 1036-1047, 2020
- Kanazawa H et al: Langenbecks Arch Surg 390: 104-113, 2005
- Eguchi S et al: Am J Surg 201: 498-502, 2011
- Usami M et al: JPEN J Parenter Enteral Nutr 35: 317-328, 2011.
- Okazaki M et al: Nutrition 29: 1224-1230, 2013
- Yokoyama Y et al: Br J Surg 101: 189-199, 2014
- Komatsu S et al: Surg Today 46: 479-490, 2016
- Rayes N et al: Am J Transplant 5: 125-130, 2005
- Rayes N et al: Ann Surg 246: 36-41, 2007
- Horvat M et al: Wien Klin Wochenschr 122, Suppl 2: 26-30, 2010
- Rayes N et al: Benef Microbes 3: 237-244, 2012
- Batra P et al: J Intensive Care 8: 81, 2020
- Shimizu K et al: J Intensive Care 9:62, 2021
- Giamarellos-Bourboulis EJ et al: J Trauma Inj Infect Crit Care 67: 815-821, 2009
- Knight DJW et al: Intensive Care Med 35:854-861, 2009
- Kotzampassi K et al: World J Surg 30: 1848-1855, 2006
- Shimizu Ket al: Crit Care 22: 239, 2018
- Skonieczna-Żydecka K, et al: J Clin Med 7: 556, 2018
- Fukaya M et al: Clin Nutr 40: 5781-5791, 2021
- Sugawara G et al: Ann Surg 244: 706-714, 2006
- Motoori M et al: Clin Nutr 41: 1112-1121, 2022
- Motoori M et al: Clin Nutr 36: 93-99, 2017
- Nakamura K et al: J Intensive Care 13: 18, 2025
- 胆道癌診療ガイドライン第4版: 日本肝胆膵外科学会, 医学図書出版



